同源康医药CDK7抑制剂TY-2699a联合用药获CDE临床批准
发布时间:2025年02月25日
同源康医药近日宣布,其自主研发的新一代口服、高效、高选择性的小分子CDK7抑制剂TY-2699a联合不同给药方案治疗晚期实体瘤获得国家药品监督管理局药品审评中心(CDE)同意开展临床试验的正式函件。此前,TY-2699a单药已获得CDE和美国食品药品监督管理局(FDA)同意开展临床试验的正式函件(Study May Proceed Letter, IND 169813)。全球目前没有获批上市的CDK7抑制剂,针对此靶点开发的药物具有广泛的临床应用前景。
关于TY-2699a
TY-2699a 是浙江同源康医药股份有限公司自主研发的一款口服的高效、高选择性的小分子CDK7抑制剂,联合给药拟用于治疗多种晚期实体瘤,包括乳腺癌、胰腺癌、头颈鳞状细胞癌。I期临床试验结果表明TY-2699a单药的整体不良反应级别低,可逆且可控,其绝大多数不良事件均为1-2级,这也和临床前体外及体内药效试验结果相互印证,即在正常细胞不敏感的剂量下,仅选择性地抑制癌细胞的生长,因此具有良好的耐受性和安全性。TY-2699a单药亦对部分受试者表现出疾病稳定的初步治疗效果。以上临床数据为联合用药临床研究的开展提供了坚实的基础。
关于CDK7联合用药
联合氟维司群或口服SERD(特异性雌激素受体降解剂)治疗乳腺癌的机制
体内研究发现,单纯CDK7抑制剂处理导致阻止雌激素受体(ER)的丝氨酸118位点磷酸化,从而上调ER表达,激活ER信号通路。当CDK抑制剂与氟维司群联用时,ER阳性乳腺癌肿瘤生长明显受到抑制。此外,RB缺失,ER突变的T47D Palbciclib耐药细胞对CDK7抑制剂非常敏感。同样的结果也被CDK7抑制剂同类药和近期发表的其它高质量研究报告证明,此外,CDK7抑制剂联合口服SERD代表ER阳性乳腺癌治疗的重要方向。
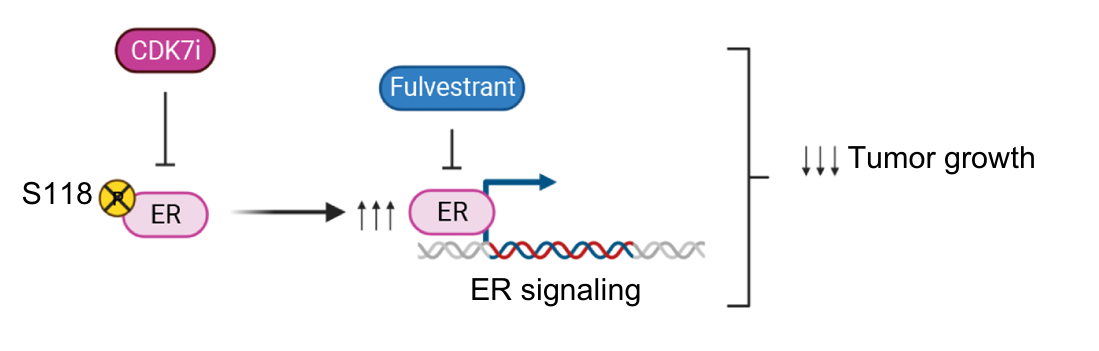
Clin Cancer Res 2024;30:1889–905
联合吉西他滨和白蛋白紫杉醇化疗药物的机制
白蛋白紫杉醇可以通过抑制吉西他滨主要代谢酶-胞苷脱氨酶的活性来增强吉西他滨的稳定性;其次,在胰腺癌中,CDK7高表达阻碍了白蛋白紫杉醇联合吉西他滨引起的肿瘤细胞凋亡,CDK7 抑制通过STAT3-MCL1-CHK1 信号通路轴来诱导细胞周期停滞,细胞凋亡,及DNA 损伤等功能。因此,靶向抑制CDK7可以显著增强白蛋白紫杉醇联合吉西他滨的疗效
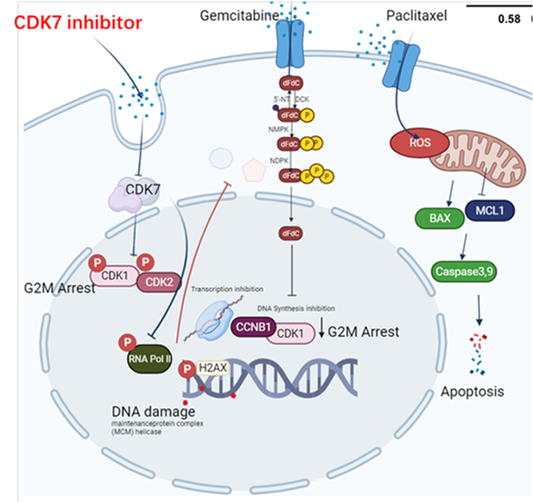
J Exp Clin Cancer Res. 2022;41(1):241.
联合PD-1抗体的作用机制
我司临床前研究显示CDK7抑制剂TY-2699a处理FaDu以及Cal-27两株细胞之后,激活免疫系统,引起免疫应激反应。同类药选择性CDK7抑制剂YKL-5-124联合抗PD-1在多种高侵袭性SCLC小鼠模型中提供了显著的生存获益,为由CDK7抑制剂和免疫疗法组成的新联合方案提供了理论依据。对于NSCLC患者,CDK7抑制剂THZ1增加了PD-1抗体的免疫治疗疗效,其机制和p38α/MYC/PD-L1通路有关。一款处于临床前阶段的同类药THZ1和和鼻咽癌细胞共培养,会导致肿瘤细胞内下游基因也就是和疗效相关的基因发生显著变化。

Cancer Cell 37, 37–54
参考文献
- Guarducci, C., et al., Selective CDK7 Inhibition Suppresses Cell Cycle Progression and MYC Signaling While Enhancing Apoptosis in Therapy-resistant Estrogen Receptor-positive Breast Cancer. Clin Cancer Res, 2024. 30(9): p. 1889-1905.
- Pancholi, S., et al., Tumour kinome re-wiring governs resistance to palbociclib in oestrogen receptor positive breast cancers, highlighting new therapeutic modalities. Oncogene, 2020. 39(25): p. 4781-4797.
- Frese, K.K., et al., nab-Paclitaxel potentiates gemcitabine activity by reducing cytidine deaminase levels in a mouse model of pancreatic cancer. Cancer Discov, 2012. 2(3): p. 260-269.
- Zeng, S., et al., CDK7 inhibition augments response to multidrug chemotherapy in pancreatic cancer. J Exp Clin Cancer Res, 2022. 41(1): p. 241.
- Bashir, B., et al., Phase 1/1b study of SY-5609, a selective and potent CDK7 inhibitor, in advanced solid tumors and in 2L/3L pancreatic ductal adenocarcinoma (PDAC) in combination with gemcitabine +/- nab-paclitaxel. 2023. 41(16_suppl): p. 3080-3080.
- Zhang, H., et al., CDK7 Inhibition Potentiates Genome Instability Triggering Anti-tumor Immunity in Small Cell Lung Cancer. Cancer Cell, 2020. 37(1): p. 37-54.e9.
- Jian W., et al., CDK7 inhibitor THZ1 enhances antiPD-1 therapy efficacy via the p38α/MYC/PD-L1 signaling in non-small cell lung cancer. J Hematol Oncol. 2020 Jul 20;13(1):99.
- Gao, L., et al., Gene expression profile of THZ1-treated nasopharyngeal carcinoma cell lines indicates its involvement in the inhibition of the cell cycle. Transl Cancer Res, 2021. 10(1): p. 445-460.
